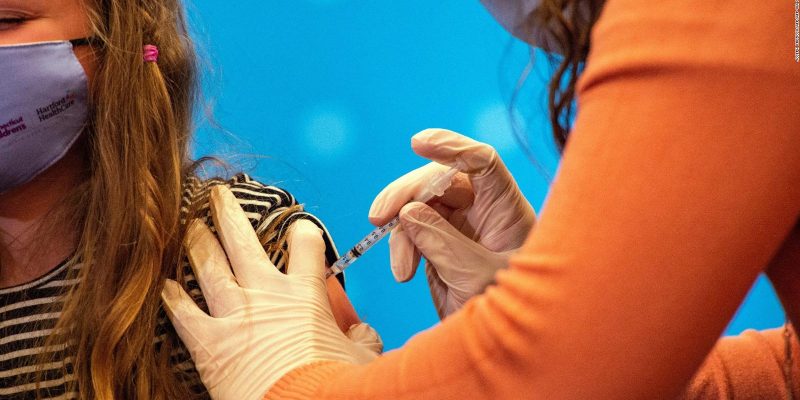
(CNN) – Pfizer y BioNTech buscan la autorización de uso de emergencia para su vacuna contra el COVID-19 de dos dosis para niños de 6 meses a 5 años, dijeron las compañías este martes.
Pfizer y BioNTech dijeron que han iniciado una presentación continua de datos a la Administración de Alimentos y Medicamentos de EE. UU. (FDA, por sus siglas en inglés) después de una solicitud de la agencia. Esperan completar la presentación de EUA en los próximos días y dicen que también enviarán datos de ensayos clínicos a la Agencia Europea de Medicamentos y otras agencias de todo el mundo.
La vacuna de Pfizer/BioNTech ya está autorizada para su uso en personas a partir de los 5 años y sería la primera vacuna contra el COVID-19 disponible para los más pequeños. Las compañías continúan probando una versión de tres dosis de la vacuna en este grupo de edad más joven.
Lee también: Moderna: Vacuna ha sido aprobada en su totalidad por la FDA
La medida surge “en respuesta a la urgente necesidad de salud pública de esta población”, dijeron las compañías en un comunicado de prensa.
Desde el comienzo de la pandemia, al menos 11,4 millones de niños dieron positivo por COVID-19, informó este lunes la Academia Estadounidense de Pediatría, con más de 3,5 millones de casos informados solo en enero. Los niños representaron el 22,8% del total de casos semanales informados durante la semana que finalizó el 27 de enero.
En diciembre, Pfizer amplió la prueba de su vacuna en niños más pequeños después de que dos dosis de la vacuna para niños no produjeran la inmunidad esperada en aquellos de 2 a 5 años, aunque sí en bebés de hasta 2 años.
Lee también: Estudio británico encuentra que algunas personas con COVID largo tienen secuelas pulmonares “ocultas”
“A medida que se han disparado las hospitalizaciones de niños menores de 5 años debido al COVID-19, nuestro objetivo común con la FDA es prepararnos para futuras oleadas de variantes y brindarles a los padres una opción para ayudar a proteger a sus hijos de este virus”, dijo el presidente y director ejecutivo de Pfizer, Albert Bourla. “En última instancia, creemos que se necesitarán tres dosis de la vacuna para niños de 6 meses a 4 años de edad para lograr altos niveles de protección contra variantes actuales y posibles futuras. Si se autorizan dos dosis, los padres tendrán la oportunidad de comenzar una serie de vacunación contra el COVID-19 para sus hijos mientras esperan la posible autorización de una tercera dosis”.
Para personas mayores de 12 años, la dosis de la vacuna Pfizer/BioNTech es de 30 microgramos de vacuna, y para niños de 5 a 11 años, se redujo a 10 microgramos. La dosis para los niños más pequeños es aún más baja: 3 microgramos por dosis.
Lee también: Lo que debes saber sobre BA.2, la nueva versión de Ómicron
CNN informó este martes que los reguladores federales animaron a Pfizer a buscar la autorización para la vacuna de dos dosis, y estos esperan que la autorización pueda otorgarse a fines de febrero. Aguardar por los datos de tres dosis podría extender la espera hasta marzo.
“Si el objetivo de la vacuna es obtener inmunidad básica en los niños, para prevenir resultados realmente malos y, en primer lugar, no se está usando la vacuna como una herramienta para prevenir infecciones, dos dosis podrían lograrlo”, dijo el Dr. Scott Gottlieb, excomisionado de la FDA y actual miembro de la junta de Pfizer, en CBS este domingo.
“Creo que esa puede ser la razón por la cual los funcionarios federales de salud están reconsiderando esto”.


Deja tu comentario