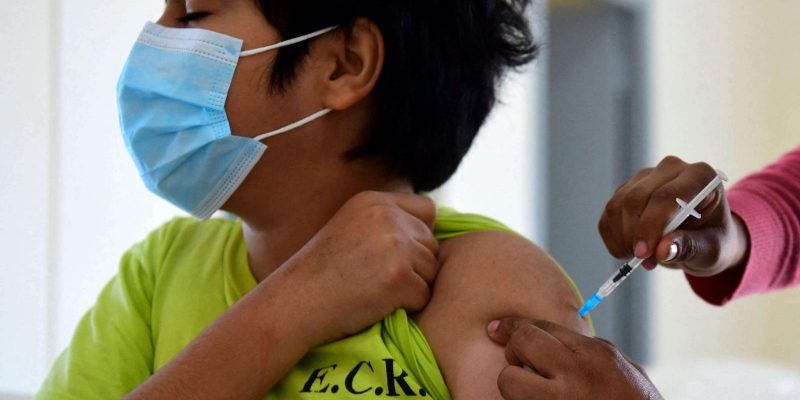
(CNN) — Pfizer y BioNTech dijeron este jueves que están solicitando la autorización de uso de emergencia de la Administración de Alimentos y Medicamentos de EE.UU. (FDA) para su vacuna contra el COVID-19 en niños de 5 a 11 años.
Si la autorizan, esta sería la primera vacuna contra el COVID-19 para niños más pequeños. La vacuna Pfizer/BioNTech está aprobada para personas de 16 años o más y tiene una autorización de uso de emergencia para personas de 12 a 15 años.
Lee también: Protección inmunológica de vacuna Pfizer disminuye a los dos meses de aplicarla, según estudios
El mes pasado, Pfizer publicó detalles de un ensayo de fase 2/3 que mostró que su vacuna era segura y que generó una respuesta de anticuerpos “robusta” en niños de 5 a 11 años.
El ensayo incluyó a 2.268 participantes de 5 a 11 años y utilizó un régimen de dos dosis de la vacuna administrada con 21 días de diferencia. Este ensayo utilizó una dosis de 10 microgramos, menor que la dosis de 30 microgramos que se ha utilizado para los mayores de 12 años.
UPDATE: We and @BioNTech_Group officially submitted our request to @US_FDA for Emergency Use Authorization (EUA) of our #COVID19 vaccine in children 5 to <12. pic.twitter.com/72Z2HXlkOx
— Pfizer Inc. (@pfizer) October 7, 2021
Las respuestas inmunitarias de los participantes se midieron observando los niveles de anticuerpos neutralizantes en su sangre y comparando esos niveles con un grupo de control de personas de 16 a 25 años que recibieron un régimen de dos dosis con la dosis más grande de 30 microgramos.
Pfizer dijo que los niveles se comparan bien con los de las personas mayores que recibieron la dosis mayor, lo que demuestra una “fuerte respuesta inmunitaria en esta cohorte de niños un mes después de la segunda dosis“. La compañía comenzó a enviar los datos a la FDA a fines del mes pasado, pero hasta ahora no había solicitado autorización formalmente.
Lee también: Investigación: Casos de miocarditis luego de vacunación con Pfizer o Moderna son poco frecuentes
Los funcionarios de la FDA habían dicho que una vez que se presentaran los datos de la vacuna para niños más pequeños, la agencia podría autorizarla en cuestión de semanas, no meses, pero dependería del momento y la calidad de los datos proporcionados.
Anticipándose a la solicitud, la FDA programó una reunión de su Comité Asesor de Vacunas y Productos Biológicos Relacionados para discutir la vacuna en niños de 5 a 11 años el 26 de octubre. Si la FDA lo aprueba, un panel de asesores de vacunas de los CDC se reunirá para considerar si recomendar su uso.


Deja tu comentario