A comienzos de 2020, los investigadores del Centro Médico de la Universidad de Vanderbilt, en Estados Unidos, comenzaron a aislar anticuerpos de pacientes con COVID-19, un hallazgo que AstraZeneca licenció para luego continuar el estudio.
El equipo de la farmacéutica optimizó estos anticuerpos con el objetivo de aumentar su durabilidad y extender su vida media con la finalidad de producir un tratamiento inyectable que sea administrado de forma preventiva contra el COVID-19.
Lee también: Dosis de refuerzo Pfizer reduce infecciones y muertes por COVID-19 en 90%, según estudios
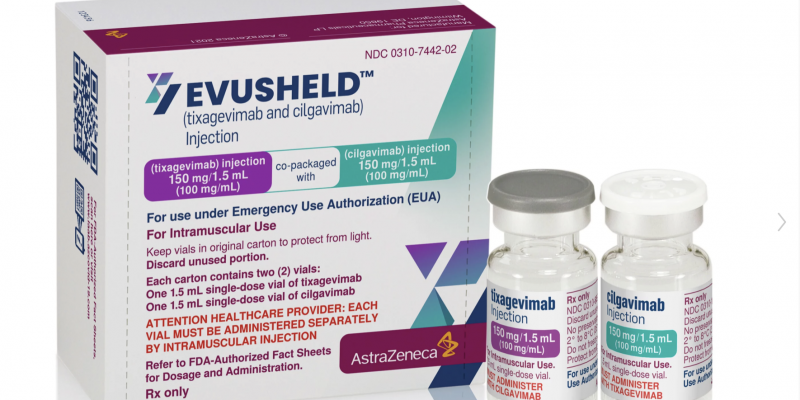
El producto final terminó en un fármaco llamado Evushield, que representa la combinación de dos anticuerpos monoclonales: tixagevimab y cilgavimab.
Su último estudio de fase 3 fue realizado en pacientes con alto riesgo de COVID-19 grave y como tratamiento posterior a la exposición del virus a pacientes hospitalizados o expuestos al COVID sin haber dado positivo.
Los datos finales demostraron que el fármaco produce un 83% menos de probabilidad de desarrollar COVID-19 sintomático durante los seis meses posteriores a su inoculación intramuscular.
Lee también: La creciente evidencia que respalda los beneficios de una dosis de refuerzo
Ya con esto en mano, la farmacéutica solicitó a la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) su uso de emergencia, uno que ya fue aprobado, pero no como una alternativa a la vacunación, sino que como un tratamiento de protección adicional para aquellas poblaciones vulnerables que no pueden mostrar una respuesta inmunitaria efectiva a partir desde las vacunas.
En relación con la expansión de la variante Ómicron, tras la realización de ensayos in vitro, detallan que Evushed neutraliza a las variantes emergentes del SARS-CoV-2, incluidas Delta y Mu.


Deja tu comentario